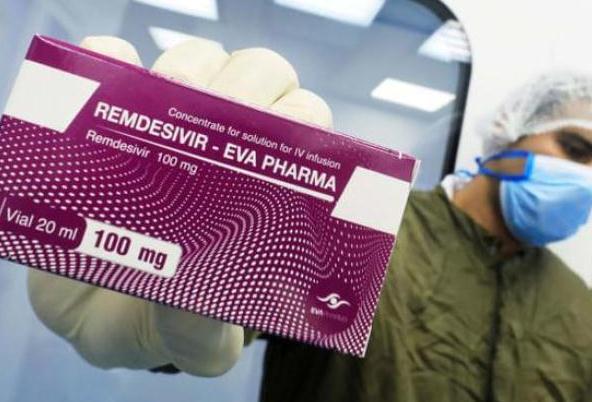
當(dāng)?shù)貢r(shí)間周四盤(pán)後,吉利德科學(xué)發(fā)布公告稱(chēng),美國(guó)食藥監(jiān)局已經(jīng)批準(zhǔn)瑞德西韋作為新冠住院患者治療藥。這也使得該藥物成為全美第一個(gè),且為唯一一個(gè)獲得FDA批準(zhǔn)的新冠治療藥物。
早在今年五月,F(xiàn)DA已經(jīng)批準(zhǔn)了該藥物緊急使用許可,作為縮短病程的抗病毒藥物,早些時(shí)候確診的美國(guó)總統(tǒng)特朗普也曾使用瑞德西韋治療。除了美國(guó)以外,瑞德西韋還在全球近50個(gè)國(guó)家獲得緊急使用許可。受到瑞德西韋獲得FDA正式批準(zhǔn)消息影響,截至發(fā)稿吉利德科學(xué)漲3.81%。

據(jù)公司介紹,F(xiàn)DA批準(zhǔn)需要住院治療的成年患者和符合條件的少兒患者(12歲以上且體重至少為40公斤)使用該藥物。批準(zhǔn)藥物上市的依據(jù)為三個(gè)近期公布的隨機(jī)對(duì)照實(shí)驗(yàn)結(jié)果,均顯示使用瑞德西韋較對(duì)照組能夠?qū)崿F(xiàn)臨床意義上的治療效果提升,目前瑞德西韋已經(jīng)成為新冠住院患者的標(biāo)準(zhǔn)治療方式。
今年八月吉利德科學(xué)曾表示,計(jì)劃在年底之前生產(chǎn)超過(guò)200萬(wàn)療程的瑞德西韋,並在明年「再增加幾百萬(wàn)療程」。目前生產(chǎn)瑞德西韋的製造網(wǎng)絡(luò)已經(jīng)囊括北美、歐洲和亞洲的四十餘家企業(yè)。